بیماریهای شبکیه، مانند دژنراسیون ماکولا (AMD)، رتینیتیس پیگمنتوزا (RP) و آموروز مادرزادی لبر (LCA)، از مهمترین علل نابینایی غیرقابلبرگشت در جهان هستند. این بیماریها اغلب به دلیل آسیب یا مرگ سلولهای حساس به نور (فتورسپتورها) و یا اختلال عملکرد سلولهای اپیتلیوم رنگدانهای شبکیه (RPE) ایجاد میشوند. تا همین چند دهه پیش، درمان این بیماریها محدود به کاهش سرعت پیشرفت بیماری یا مدیریت عوارض بود و عملا بازگرداندن بینایی امری غیرممکن به نظر میرسید. اما اکنون، با پیشرفتهای شگفتانگیز در علوم ژنتیک، بیوتکنولوژی و مهندسی بافت، دو رویکرد ژندرمانی و سلولدرمانی در خط مقدم تحقیقات قرار گرفتهاند و چشمانداز تازهای برای بیماران و پزشکان ایجاد کردهاند.
ژندرمانی شبکیه: دستاوردها و مطالعات کلینیکی
ژندرمانی شبکیه با هدف اصلاح ژنهای معیوب یا جایگزینی آنها انجام میشود و توانایی بازگرداندن عملکرد بینایی را دارد. این روش به ویژه برای بیمارانی که سالها با نابینایی دستوپنجه نرم کردهاند، امیدبخش است. در ادامه، مکانیزم، دستاوردهای بالینی و پروژههای در حال انجام بررسی میشود.

مکانیزم ژندرمانی
ژندرمانی با هدف اصلاح یا جایگزینی ژنهای معیوب در سلولهای شبکیه انجام میشود. این کار معمولا از طریق ناقلهای ویروسی بیضرر (مثل AAV) صورت میگیرد و میتواند عملکرد سلول را بازگرداند یا از مرگ آن جلوگیری کند.
درمانهای تاییدشده و موفق
- Luxturna (Voretigene neparvovec): نخستین ژندرمانی تاییدشده توسط FDA برای درمان LCA ناشی از جهش RPE65. این درمان با تزریق زیرشبکیهای و فقط یک بار انجام میشود و باعث بهبود بینایی و توانایی دید در نور کم شده است.
جهت اخذ نوبت و برقراری ارتباط با دکتر منصور همایونی، بر روی دکمه زیر کلیک کنید و وقت مشاوره خود را رزرو کنید.
نمونههای بالینی موفق
- کودک ۲ سالهای در لندن با ژندرمانی AIPL1 توانست پس از هفتهها بینایی قابل استفاده پیدا کند.
- مرد ۳۱ سالهای در ایرلند، که ۱۳ سال نابینا بود، با Luxturna توانست مجددا متن بخواند.
پروژههای در حال انجام
- OCU400 برای RP ناشی از جهش NR2E3 در فاز 3.
- Sepofarsen برای LCA10 (جهش CEP290) و Ultevursen برای USH2A در فاز 2b.
شاید این مطلب برای شما مفید باشد: درمان های جدید در بیماری های شبکیه
سلولدرمانی شبکیه: بازسازی بافت آسیبدیده
سلولدرمانی رویکردی نوین برای بازگرداندن عملکرد شبکیه است. با پیوند سلولهای سالم به جای سلولهای آسیبدیده، این روش میتواند بینایی را بازیابی کند. در این بخش منابع سلولی، درمانهای بالینی و چالشهای پیشرو بررسی میشوند.

منابع سلولی و انواع آن
سلولدرمانی تلاش میکند با پیوند سلولهای سالم به جای سلولهای تخریبشده، عملکرد شبکیه را بازیابی کند. این سلولها میتوانند از منابع مختلفی مثل سلولهای بنیادی جنینی (hESC)، سلولهای بنیادی خونساز (CD34+) یا سلولهای بنیادی القایی (iPSC) به دست آیند.
درمانهای بالینی و نتایج
- OpRegen (RG6501): پیوند سلولهای RPE مشتقشده از hESC در بیماران مبتلا به AMD خشک، که باعث بهبود پایدار بینایی در برخی بیماران تا ۳ سال شد.
- تزریق سلولهای CD34+: مطالعه UC Davis نشان داد که این روش در بیماران RP بیخطر است و حتی در برخی بیماران بهبود میدان بینایی مشاهده شد.
- سلولهای iPSC: اولین پیوند موفق RPE مشتقشده از iPSC به انسان در ژاپن انجام شد و ایمنی آن تایید شد.

چالشها و تحقیقات آینده
علاوه بر RPE، تحقیقات روی بازسازی فتورسپتورها با استفاده از سلولهای بنیادی عصبی یا سلولهای شبکیه پیشتمایز یافته، نتایج امیدوارکنندهای در مدلهای حیوانی نشان داده است. یکی از چالشهای اصلی، اطمینان از بقای طولانیمدت و عملکرد هماهنگ سلولهای پیوندی با شبکه عصبی شبکیه است.
مسیرهای انتقال درمان
تحویل ژن و سلول به شبکیه یکی از پیچیدهترین بخشهای درمان است. روشهای مختلف با مزایا و محدودیتهای خاص خود وجود دارند که بر اساس نوع درمان و شرایط بیمار انتخاب میشوند.
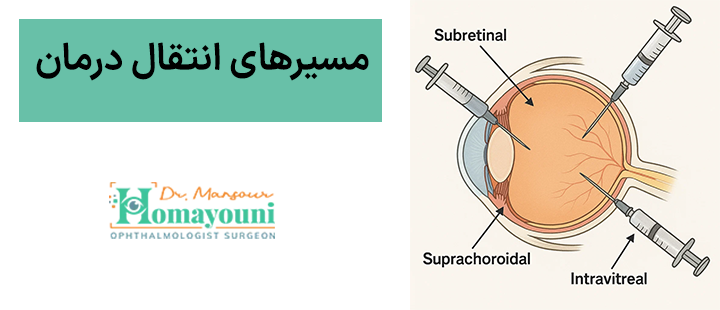
مسیر زیرشبکیهای (Subretinal)
دقت بالا، اثربخشی بیشتر، اما نیازمند جراحی و دستکاری دقیق بافت شبکیه. این روش برای پیوند سلولها و ژنهای بزرگتر مناسبتر است.
مسیر سوپراکوروئیدال (Suprachoroidal)
کمتر تهاجمی و قابل انجام در مطب، با التهاب کمتر و احتمال آسیب کمتر به بافت شبکیه.
مسیر داخل زجاجیهای (Intravitreal)
سادهترین روش، ولی عبور ناقلها و سلولها از غشای داخلی شبکیه (ILM) محدود است و ممکن است نیازمند تکنولوژیهای جدید مانند نانوذرات یا ژلهای حامل باشد.
برای مشاهده نظرات بیماران، به پروفایل دکتر منصور همایونی در مطب چی مراجعه نمایید.
چشمانداز آینده و چالشها
با وجود موفقیتهای اولیه، هنوز مسیر طولانی برای تثبیت این درمانها وجود دارد. پژوهشها در حال بررسی ایمنی بلندمدت، کاهش هزینهها و توسعه روشهای شخصیسازی شده هستند.

ایمنی بلندمدت
باید اثرات طولانیمدت ژندرمانی و سلولدرمانی روی بافت شبکیه و سیستم ایمنی بررسی شود.
هزینههای درمان
قیمت بالای درمانهای نوین مانع دسترسی گسترده بیماران است و نیازمند راهکارهای اقتصادی و سیاستهای حمایتی است.
تنوع ژنتیکی بیماریها
وجود بیش از هزار جهش مرتبط با RP و سایر بیماریهای شبکیه نیازمند راهکارهای انعطافپذیر و شخصیسازی درمان است.
چالشهای فنی
ادغام سلولهای پیوندی با شبکه عصبی موجود، طول عمر آنها، و کنترل واکنشهای التهابی و فیبروتیک نیازمند تحقیقات بیشتر است.
چشمانداز روشن
روند تحقیقات نشان میدهد که در آیندهای نهچندان دور، بیماران بیشتری میتوانند از این درمانها بهرهمند شوند. توسعه ترکیبی ژندرمانی و سلولدرمانی، استفاده از سیستمهای تحویل دقیق و کاهش هزینهها، افق تازهای در درمان نابیناییهای غیرقابل برگشت ایجاد کرده است.

